Reaksi Adisi Organometalic Pada Senyawa Karbonil
-ADISI ORGANOMETALIK
Reaksi Pembuatan Senyawa Organologam
Terdapat banyak cara untuk membentuk ikatan-ikatan logam antara karbon dengan logam transisi dan nontransisi. Beberapa yang penting adalah sebagai berikut :
1. Reaksi logam langsung
Mg + CH3I → CH3MgI
2. Penggunaan zat pengalkilasi
PCl3 + 3C6H5MgCl → P(C6H5)3 + 3MgCl2
VOCl3 + 3(CH3)SiCH2MgCl → VO(CH2SiMe3)3 + 3MgCl2
PtCl2(Pet3)2 + CH3MgCl → PtCl(CH3)(Pet2)2 + MgCl2
3. Interaksi hidrida logam atau nonlogam dengan alkena atau alkuna
1/2 B2H6 + 3 C=C → B-(C=C)3
4. Reaksi oksidasi Adidi
Dimana alkil atau aril halida ditambahkan kepada senyawa logam transisi terkoordinasi tidak jenuh menghasilkan ikatan logam karbon.
RhCl(PPh3)3 + CH3I → RhClI(CH3)(PPh3)2 + PPh3
5. Reaksi Inseri
Reaksi-Reaksi Senyawa Organologam
Gambar 1. Reaksi senyawa organologam dengan senyawa karbonil
Gambar 2. Reaksi senyawa organologam
1. Substitusi
Reaksi penggantian suatu gugus dengan gugus lain
2. Eliminasi
Reaksi penggantian ikatan, dari ikatan tunggal menjadi rangkap.
3. Oksidasi
4. Adisi
Reaksi adisi adalah reaksi pengubahan senyawa yang berikatan rangkap (tak jenuh) menjadi senyawa yang berikatan tunggal (jenuh) dengan cara menambahkan atom dari senyawa lain. Reaksi adisi hanya dapat terjadi pada senyawa yang memiliki ikatan rangkap. Atau dengan kata lain reaksi adisi adalah reaksi penambahan suatu atom atau gugus atom kedalam senyawa.
Reaksi Grignard
Reaksi Grignard adalah reaksi kimia organologam di mana alkil - atau Aril-magnesium halides (reagen Grignard) menambah gugus karbonil Aldehida atau keton. Reaksi ini adalah alat penting untuk pembentukan ikatan antar karbon. Reaksi Halida organik dengan magnesium bukan reaksi Grignard, tetapi menyediakan peraksi Grignard. Pereaksi Grignard memiliki rumus umum RMgX dimana X adalah sebuah halogen, dan R adalah sebuah gugus alkil atau aril (berdasarkan pada sebuah cincin benzen). Pereaksi Grignard sederhana bisa berupa CH3CH2MgBr.
Mekanisme Reaksi :
Reagen Grignard berfungsi sebagai nukleofil, menyerang atom karbon elektrofilik yang hadir dalam ikatan polar gugus karbonil. Penambahan pereaksi Grignard untuk karbonil biasanya hasil melalui keadaan transisi enam-beranggota cincin.
Namun, dengan pereaksi Grignard terhalang, reaksi dapat melanjutkan dengan transfer elektrontunggal. Jalur serupa diasumsikan untuk reaksi lain dari reagen Grignard, misalnya, dalam pembentukan ikatan antara karbon-fosfor, timah-karbon, karbon-silikon, boron-karbon dan karbon-heteroatom.
-ALKILASI
Alkilasi Enolat
Salah satu reaksi yang paling penting dari enolat adalah alkilasi oleh
adanya perlakuan dengan alkil halida. Reaksi ini sangat berguna untuk tujuan
sintesis karena memungkinkan pembentukan ikatan karbon-karbon baru, yaitu
menggabungkan dua senyawa yang lebih kecil menjadi molekul yang lebih
besar. Alkilasi terjadi bila anion enolat yang nukleofilik bereaksi dengan alkil
halida yang elektrofilik dan memaksa keluar ‘leaving group’ melalui mekanisme
SN2. Reaksi dapat terjadi pada atom oksigen enolat atau karbon alfa, tetapi
secara normal terjadi pada atom karbon.
Sintesis Ester Malonat
Sintesis ester malonat merupakan salah satu reaksi alkilasi karbonil yang
terkenal dan tertua dan merupakan metoda yang bagus untuk membuat asam
asetat yang tersubstitusi α dari alkil halida.
-REAKSI MICHAEL
Adisi terhadap olefin aktif biasa dinyatakan sebagai reaksi Michael. Olefin dapatdiaktifkan dengan cara berkonjugasi dengan gugus karbonil, karboalkoksi, nitro,dan nitril; dan komponen pembentuk karbanion dapatmerupakan senyawa bifungsi seperti ester malonat, atau senyawa monofungsi seperti nitrometana.Sebagai contoh
Adisi Michael dapat secara spotanmengikuti kondensasi aldehida alifatikdengan ester malonat.
Hidrolisis dan dekarboksilasi produk ini akan menghasilkan asam glutarattersubstitusi.
Adisi Michael ke keton ,-tak-jenuh dapat diikuti dengan kondensasiClaisen intramolekul dalam molekulnya sendiri. Sebagai contoh, dimedon(meton) dapat dibuat dengan rendamen di atas 80% dari mesitil oksida dan estermalonat dalam adanya ion etoksida.
MATERI IV
REAKSI KONDENSASI KARBONIL
Reaksi Kondensasi Karbonil
Reaksi aldol merupakan kombinasi yang sederhana dari dari tahap adisi imkieofilik dan tahap substitusi a. Ion enolat yang mula-mula terbentuk dari asetalldehida berlaku sebagai nukleofil dan menyerang gugus karbonil dari molekul asetaldehida yang lain.
Ion hidroksi mengambil proton alfa yang bersifat asam dari satu molekul asetaldehida, menghasilkan ion enolat.
Nukleofil ion enolat menyerang gugus karbonil dari molekul asetalhida yang lain, menghasilkan intermediet tetrahedral.
Intermediet terprotonasi oleh solven air menghasilkan produk aldol yang netral dan membebaskan ion hidroksida.
MATERI V
SINTESIS ASIMETRIK DENGAN ENOLAT(Reaksi Pembentukan Enolat)
Mekanisme Enolat
Jika katalis yang digunakan merupakan basa yang moderat seperti ion hidroksida atau sebuah alkoksida, reaksi aldol akan terjadi melalui serangan nukleofilik oleh enolat pada gugus karbonil molekul lain yang terstabilisasi oleh resonansi. Produk reaksi ini adalah garam alkoksida dari produk aldol. Aldol itu sendiri akan terbentuk dan dapat mengalami dehidrasi, menghasilkan senyawa karbonil takjenuh. Gambar di bawah ini menunjukkan mekanisme sederhana untuk reaksi swakondensasi aldehida yang dikatalisasikan oleh basa.
Reaksi Aldol Dengan Katalis Basa (Diperlihatkan Menggunakan −OCH3 Sebagai Basa)
MATERI VI
REAKSI PEMBENTUKAN CINCIN(Pembentukan Cincin Medium)
Tahap pertam,, : Pada tahap ini terjadi reaksi substitusi –OMe.
Tahap kedua, : Pada tahap ini, CN direduksi oleh LAH menjadi NH2.
Tahap ketigaa, : Pada tahap ini, gugus pelindung Bn dihilangkan dengan menggunakan katalis Pd, karbon untuk menyerap air dan methanol untuk mengasamkan.
Tahap keempat, : Pada tahap selanjutnya adalah dengan mengoksidasi senyawa yang telah didapat dan menggunakan metanol sebagai pelarut.
PERTANYAAN :
1.Pada senyawaan yang terikat secara nonklasik. Dalam hal tersebut, terdapat atom yang memiliki sifat kekurangan elektron seperti atom boron pada B(CH3)3. Mengapa hal tersebut dapat terjadi? Jelaskan!
2. Apa yang menyebabkan sehingga pada reaksi grignard bisa disebut reaksi subsitusi tetapi mereka tidak diklasifikasikan sebagai subsitusi nukleofilik? Jelaskan!
3. Semua alkil halida berekasi dengan dengan magnesium terkecuali alkil fluorida nah maka coba jelaskan mengapa suatu alkil fluorida tidak bereaksi dengan magnesium pada suatu eter?

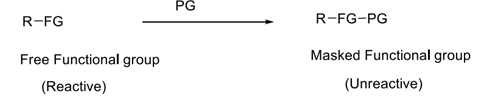
Baiklah nadia saya akan mencoba menjawab permasalahan nomor 3
BalasHapusOrganik halida dan magnesium dalam eter bereaksi membentuk pereaksi Grignard (RMgX) yang merupakan spesies-antara yang reaktif.
Alkil fluorida tidak bereaksi dengan magnesium dalam eter. Alkil klorida cenderung bereaksi dengan lambat, dan aril halida tidak bereaksi. Alkil bromida dan alkil iodida keduanya dengan cepat bereaksi dengan magnesium, tapi bromida lebih sering digunakan karena lebih murah dan mudah diperoleh.
Dalam pembuatan dan penanganan senyawa oragnologam reaktif seperti pereaksi Grignard, kita mencegahnya kontak dengan udara atau pelarut-pelarut protik. Bekerja dengan zat-zat ini dianjurkan menggunakan pelarut kering dan atmosfir inert. Sebagai contoh, air menghidrolisis pereaksi Gridnard mengahsilkan alkana.
Oleh karena ikatan karbon-magnesium terpolarisasi dengan muatan parsil negatif pada karbon dan muatan parsil positif pada magnesium, penataan ulang tidak pernah menyertai ion karbonium yang terbentuk dari pereaksi Grignard. Sebagai contoh, pereaksi Grignard dapat dibuat dari neopentil klorida tanpa terjadinya pentaan ulang. Dalam pembuatan pereakasi Grignard dari aril klorida dan vinil halida yang kurang reaktif, umumnya tetrahidrofuran digunakan sebagai pelarut.
Saya akan mencoba menjawab permasalahan pertama.
BalasHapusDalam banyak senyawaan organologam terdapat suatu jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam bentuk ionik atau pasangan elektron/kovalensi. Misalnya, salah satu kelas alkil terdiri dari Li, Be, dan Al yang memiliki gugus-gugus alkil berjembatan. Dalam hal ini, terdapat atom yang memiliki sifat kekurangan elektron seperti atom Boron pada B(CH3)3. Atom B termasuk atom golongan IIIA, dimana memiliki 3 elektron valensi, sehingga cukup sulit untuk membentuk konfigurasi oktet dalam senyawaannya. Terdapat kekurangan elektron seperti dalam bor hidrida, dan ikatannya mirip jenis yang berpusat banyak. Kelas kedua yang jauh lebih besar terdiri atas senyawaan logam-logam transisi dengan alkena, alkuna, benzene, dan system cincin lainnya seperti C5H5-. Mula-mula akan diperlihatkan senyawaan organo dari unsure-unsur golongan utama, termasuk yang berikatan nonklasik, dan kemudian pada senyawaan logam transisi.
Saya akan mencoba menjawab permasalahan pertama.
BalasHapusDalam banyak senyawaan organologam terdapat suatu jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam bentuk ionik atau pasangan elektron/kovalensi. Misalnya, salah satu kelas alkil terdiri dari Li, Be, dan Al yang memiliki gugus-gugus alkil berjembatan. Dalam hal ini, terdapat atom yang memiliki sifat kekurangan elektron seperti atom Boron pada B(CH3)3. Atom B termasuk atom golongan IIIA, dimana memiliki 3 elektron valensi, sehingga cukup sulit untuk membentuk konfigurasi oktet dalam senyawaannya. Terdapat kekurangan elektron seperti dalam bor hidrida, dan ikatannya mirip jenis yang berpusat banyak. Kelas kedua yang jauh lebih besar terdiri atas senyawaan logam-logam transisi dengan alkena, alkuna, benzene, dan system cincin lainnya seperti C5H5-. Mula-mula akan diperlihatkan senyawaan organo dari unsure-unsur golongan utama, termasuk yang berikatan nonklasik, dan kemudian pada senyawaan logam transisi.
saya akan menjawab Permasalahan nomor 2 Pereaksi Grignard mirip dengan pereaksi organolitium karena keduanya merupakan nukleofil kuat yang dapat membentuk ikatan karbon–karbon baru. Reaksi-reaksi ini jelas reaksi substitusi, tetapi mereka tidak dapat diklasifikasikan sebagai substitusi nukleofilik, seperti reaksi awal dari alkil halida. Karena atom karbon fungsional telah berkurang, polaritas kelompok fungsional yang dihasilkan terbalik (suatu karbon awalnya elektrofilik menjadi nukleofilik). Perubahan ini, yang ditunjukkan di bawah, membuat alkil litium dan Grignard reagen reaktan yang unik dan berguna dalam sintesis.
BalasHapusPermasalahan 3 pembuatan dan penanganan senyawa oragnologam reaktif seperti pereaksi Grignard, kita mencegahnya kontak dengan udara atau pelarut-pelarut protik. Bekerja dengan zat-zat ini dianjurkan menggunakan pelarut kering dan atmosfir inert. Sebagai contoh, air menghidrolisis pereaksi Gridnard mengahsilkan alkana.
BalasHapusOleh karena ikatan karbon-magnesium terpolarisasi dengan muatan parsil negatif pada karbon dan muatan parsil positif pada magnesium, penataan ulang tidak pernah menyertai ion karbonium yang terbentuk dari pereaksi Grignard.
Saya akan mencoba menjawab permasalahan pertama.
BalasHapusDalam banyak senyawaan organologam terdapat suatu jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam bentuk ionik atau pasangan elektron/kovalensi. Misalnya, salah satu kelas alkil terdiri dari Li, Be, dan Al yang memiliki gugus-gugus alkil berjembatan. Dalam hal ini, terdapat atom yang memiliki sifat kekurangan elektron seperti atom Boron pada B(CH3)3. Atom B termasuk atom golongan IIIA, dimana memiliki 3 elektron valensi, sehingga cukup sulit untuk membentuk konfigurasi oktet dalam senyawaannya. Terdapat kekurangan elektron seperti dalam bor hidrida, dan ikatannya mirip jenis yang berpusat banyak. Kelas kedua yang jauh lebih besar terdiri atas senyawaan logam-logam transisi dengan alkena, alkuna, benzene, dan system cincin lainnya seperti C5H5-. Mula-mula akan diperlihatkan senyawaan organo dari unsure-unsur golongan utama, termasuk yang berikatan nonklasik, dan kemudian pada senyawaan logam transisi.
Saya akan mencoba menjawab permasalahan Anda yg ke-2:
BalasHapusPenyebabnya karena atom karbon fungsional telah berkurang, polaritas kelompok fungsional yang dihasilkan terbalik (suatu karbon awalnya elektrofilik menjadi nukleofilik). Perubahan ini, yang ditunjukkan di bawah, membuat alkil litium dan Grignard reagen reaktan yang unik dan berguna dalam sintesis.
Saya akan mencoba menjawab permasalahan pertama.
BalasHapusDalam banyak senyawaan organologam terdapat suatu jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam bentuk ionik atau pasangan elektron/kovalensi. Misalnya, salah satu kelas alkil terdiri dari Li, Be, dan Al yang memiliki gugus-gugus alkil berjembatan. Dalam hal ini, terdapat atom yang memiliki sifat kekurangan elektron seperti atom Boron pada B(CH3)3. Atom B termasuk atom golongan IIIA, dimana memiliki 3 elektron valensi, sehingga cukup sulit untuk membentuk konfigurasi oktet dalam senyawaannya. Terdapat kekurangan elektron seperti dalam bor hidrida, dan ikatannya mirip jenis yang berpusat banyak. Kelas kedua yang jauh lebih besar terdiri atas senyawaan logam-logam transisi dengan alkena, alkuna, benzene, dan system cincin lainnya seperti C5H5-. Mula-mula akan diperlihatkan senyawaan organo dari unsure-unsur golongan utama, termasuk yang berikatan nonklasik, dan kemudian pada senyawaan logam transisi.
menjawab permasalahan pertama.
BalasHapusDalam banyak senyawaan organologam terdapat suatu jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam bentuk ionik atau pasangan elektron/kovalensi. Misalnya, salah satu kelas alkil terdiri dari Li, Be, dan Al yang memiliki gugus-gugus alkil berjembatan. Dalam hal ini, terdapat atom yang memiliki sifat kekurangan elektron seperti atom Boron pada B(CH3)3. Atom B termasuk atom golongan IIIA, dimana memiliki 3 elektron valensi, sehingga cukup sulit untuk membentuk konfigurasi oktet dalam senyawaannya. Terdapat kekurangan elektron seperti dalam bor hidrida, dan ikatannya mirip jenis yang berpusat banyak. Kelas kedua yang jauh lebih besar terdiri atas senyawaan logam-logam transisi dengan alkena, alkuna, benzene, dan system cincin lainnya seperti C5H5-. Mula-mula akan diperlihatkan senyawaan organo dari unsure-unsur golongan utama, termasuk yang berikatan nonklasik, dan kemudian pada senyawaan logam transisi.
Pereaksi Grignard mirip dengan pereaksi organolitium karena keduanya merupakan nukleofil kuat yang dapat membentuk ikatan karbon–karbon baru. Reaksi-reaksi ini jelas reaksi substitusi, tetapi mereka tidak dapat diklasifikasikan sebagai substitusi nukleofilik, seperti reaksi awal dari alkil halida. Karena atom karbon fungsional telah berkurang, polaritas kelompok fungsional yang dihasilkan terbalik (suatu karbon awalnya elektrofilik menjadi nukleofilik)
BalasHapusSaya akan mencoba menjawab permasalahan pertama.
BalasHapusDalam banyak senyawaan organologam terdapat suatu jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam bentuk ionik atau pasangan elektron/kovalensi. Misalnya, salah satu kelas alkil terdiri dari Li, Be, dan Al yang memiliki gugus-gugus alkil berjembatan. Dalam hal ini, terdapat atom yang memiliki sifat kekurangan elektron seperti atom Boron pada B(CH3)3. Atom B termasuk atom golongan IIIA, dimana memiliki 3 elektron valensi, sehingga cukup sulit untuk membentuk konfigurasi oktet dalam senyawaannya. Terdapat kekurangan elektron seperti dalam bor hidrida, dan ikatannya mirip jenis yang berpusat banyak. Kelas kedua yang jauh lebih besar terdiri atas senyawaan logam-logam transisi dengan alkena, alkuna, benzene, dan system cincin lainnya seperti C5H5-. Mula-mula akan diperlihatkan senyawaan organo dari unsure-unsur golongan utama, termasuk yang berikatan nonklasik, dan kemudian pada senyawaan logam transisi.
saya akan mencoba menjawab permasalahan nomor 3
BalasHapusOrganik halida dan magnesium dalam eter bereaksi membentuk pereaksi Grignard (RMgX) yang merupakan spesies-antara yang reaktif.
Alkil fluorida tidak bereaksi dengan magnesium dalam eter. Alkil klorida cenderung bereaksi dengan lambat, dan aril halida tidak bereaksi. Alkil bromida dan alkil iodida keduanya dengan cepat bereaksi dengan magnesium, tapi bromida lebih sering digunakan karena lebih murah dan mudah diperoleh
No 1 Dalam banyak senyawaan organologam terdapat suatu jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam bentuk ionik atau pasangan elektron/kovalensi. Misalnya, salah satu kelas alkil terdiri dari Li, Be, dan Al yang memiliki gugus-gugus alkil berjembatan. Dalam hal ini, terdapat atom yang memiliki sifat kekurangan elektron seperti atom Boron pada B(CH3)3. Atom B termasuk atom golongan IIIA, dimana memiliki 3 elektron valensi, sehingga cukup sulit untuk membentuk konfigurasi oktet dalam senyawaannya
BalasHapusPermasalahan nomor 2 Pereaksi Grignard mirip dengan pereaksi organolitium karena keduanya merupakan nukleofil kuat yang dapat membentuk ikatan karbon–karbon baru. Reaksi-reaksi ini jelas reaksi substitusi, tetapi mereka tidak dapat diklasifikasikan sebagai substitusi nukleofilik, seperti reaksi awal dari alkil halida. Karena atom karbon fungsional telah berkurang, polaritas kelompok fungsional yang dihasilkan terbalik (suatu karbon awalnya elektrofilik menjadi nukleofilik). Perubahan ini, yang ditunjukkan di bawah, membuat alkil litium dan Grignard reagen reaktan yang unik dan berguna dalam sintesis.
BalasHapus